Białka adhezyjne w komórkach nowotworowych
Monika Mach | 2005-01-21
Adhezja komórek odgrywa kluczowa rolę w regulacji takich procesów jak wzrost, różnicowanie się i migracja komórki. Białka odpowiedzialne za adhezje tzw. CAMs (ang. cellular adhesion molecules) pośredniczą w oddziaływaniach między komórkami oraz między komórkami a macierzą międzykomórkową. Dotychczas zidentyfikowano ponad 50 białek biorących udział w adhezji, są to: integryny, selektyny, kadheryny oraz immunopodobne CAMs-Ig. Każda z tych białkowych rodzin posiada charakterystyczne motywy budowy, jak również różni się pełnionymi funkcjami w adhezji komórek, udziałem w tworzeniu ognisk kontaktowych, pasów adhezyjnych, desmosomów czy hemidesmosomów. Należy także nadmienić, że w tworzeniu połączeń zakotwiczonych zaangażowane są również elementy szkieletu komórkowego: filamenty aktynowe oraz filamenty pośrednie.
W normalnych komórkach prawidłowy proces adhezji jest podstawą takich procesów jak ruch komórki, komunikacja międzykomórkową czy przekazywanie sygnału. Wszystkie białka adhezyjne zaangażowane są w różnym stopniu w regulację procesów komórkowych, rozpoznanie odpowiednich receptorów, proces apoptozy, jak również w odpowiedź immunologiczną organizmu np. podczas zapalenia.
Komórki nowotworowe łamią podstawowe zasady, którym podlegają normalne komórki. Główne cechy komórek nowotworowych umożliwiające im niszczenie organizacji tkanek to niekontrolowane podziały komórkowe a także zdolność ominięcia programowanej śmierci komórki czyli apoptozy. Komórki nowotworowe są zdolne do rozprzestrzeniania się po organizmie wykorzystując dwa mechanizmy:
- inwazyjność, odnoszącą się do migracji w obrębie otaczających komórek oraz
- metastazję (ang. metastasis) oznaczającą zdolność komórek nowotworowych do penetracji ścian naczyń krwionośnych i limfatycznych, przemieszczania się do innych, często odległych tkanek i tworzenia wtórnych guzów (ang. malignant, cancer).
Inwazyjność i zdolność komórek nowotworowych do metastazy jest najpoważniejszym problemem w walce z rakiem. Proces ten poprzedza utrata integralności i adhezji między komórkami oraz macierzą międzykomórkową [1]. W 1944 roku, Coman po raz pierwszy zauważył, że istnieje widoczna korelacja między zmienionym poziomem białek odpowiedzialnych za adhezję a zdolnością komórek nowotworowych do inwazji [5]. Przechodzenie komórek nowotworowych do naczyń krwionośnych i limfatycznych (ang. intravasation) wymaga utraty wewnątrzkomórkowych kontaktów co sugeruje, że CAMs są nierozerwalnie związane z inwazją i metastazją nowotworów. Co więcej, niektóre wirusy wykorzystują CAM jako specyficzne receptory. To rzuca nowe światło na białka adhezyjne, jako potencjalne cele terapii przeciwnowotworowej [1].
Coraz więcej dowodów wskazuje, że nieprawidłowości w adhezji są istotnym czynnikiem generującym inwazyjność komórek nowotworowych. Co więcej te właśnie cechy komórek nowotworowych korelują ze zmniejszoną ekspresją, w szczególności kadheryn. Utrata wewnątrzkomórkowych kontaktów na skutek zmniejszenia ilości kadheryn, glikoprotein odpowiadających za rozpoznanie komórek, adhezję oraz siłę oddziaływań między komórkami, wytwarza korzystne warunki dla inwazyjnych komórek nowotworowych, umożliwiając im migrację [2]. Klasyczne kadheryny, N-, E-, i P- tworzą tzw. połączenia przylegające (ang. adherence junctions) i pełnią różne role w adhezji między komórkami [1]. W różnych liniach komórek nowotworowych obserwuje się relokalizację oraz zmniejszoną ekspresję kadheryn, skorelowaną ze stopniem inwazyjności nowotworu [1, 5]. E-kadheryny wydają się być czynnikami znoszącymi inwazyjność komórek nowotworowych, gdyż ponowna rekonstrukcja tych białek adhezyjnych hamowała potencjał metastatyczny nowotworów. Wskazują na to badania wykorzystujące transgeniczne myszy z komórkami nowotworowymi b trzustki (model Rip1Tag2). Podobnie jak w wielu ludzkich nowotworach, również u myszy Rip1Tag2 obserwowana jest zmniejszona ekspresja E-kadheryn podczas przejścia ze stadium pierwotnego (ang. benign, adenomas) do postaci złośliwej (ang. malignant, carcinomas) nowotworu. Ekspresja E-kadheryn w komórkach b trzustki u transgenicznych mysz Rip1Tag2 powodowała zatrzymanie rozwoju nowotworu na etapie nieinwazyjnym (ang. adenomas). To wskazuje, że kadheryny, nie tylko uczestniczą w adhezji między komórkami ale także, przynajmniej pośrednio, hamują rozwój nowotworu. Brak kadheryn stanowi jeden z czynników indukujących metastazję komórek nowotworowych, prawdopodobnie przez transdukcję szlaków sygnałowych i czynników aktywujących komórki nowotworowe do inwazji sąsiadujących komórek i tkanek. Dane wskazują, że zmniejszona ekspresja kadheryn może stać się markerem komórek nowotworów: piersi, prostaty, jelita oraz żołądka [5].
W normalnych warunkach zewnątrzkomórkowa domena E-kadheryn oddziałuje z kolejną, zwykle taką samą kadheryną na powierzchni sąsiadującej komórki. Poprzez kateniny, kadheryny łączą się z elementami szkieletu aktynowego, co w efekcie tworzy funkcjonalny kompleks adhezyjny utrzymujący komórki razem. Kateniny biorą udział również w przekazywaniu sygnału przez Wnt. W połączeniach adhezyjnych między komórkami, kateniny występują w formie związanej. Natomiast wolne kateniny są szybko fosforylowane przez GSK-3b (glycogen synthetase kinase), a następnie degradowane. W przypadku komórek nowotworowych GSK-3b jest aktywnie blokowany przez Wnt, dlatego kateniny akumulują się w wysokim stężeniu w cytoplazmie. Następnie przenoszone są do jądra, gdzie wiążą się z czynnikami transkrypcyjnymi TCF/LEF-1 co aktywuje ekspresję określonych onkogenów, jak c-Myc czy cykliny D1. Oczywiście podwójna rola katenin w adhezji komórek wymaga jeszcze wielu wyjaśnień związanych z nowotworzeniem, m.in. czy brak funkcjonalnych E-kadheryn może indukować aktywację katenin zależnie od Wnt?
Brak funkcjonalnych kadheryn, pociąga za sobą także zmiany w organizacji szkieletu komórkowego. Małe GTPazy, białka RhoA, Rac1 oraz Cdc42, które kontrolują organizację filamentów aktynowych w komórce oraz jej ruchliwość, modulują również, poprzez regulację aktywności kadheryn, adhezję międzykomórkową. Stąd małe GTPazy mogą odgrywać istotną rolę podczas karcenogenezy. W rzeczywistości, małe GTPazy regulują funkcje onkogennego białka Ras, należącego do rodziny białek Rho, które zwiększają metastatyczny potencjał komórek nowotworowych. Kolejny przykład stanowi IQGAP1, czynnik efektorowy działania białek Rho (w tym przypadku Rac1 i Cdc42), którego poziom w komórkach nowotworowych się zmienia. Czynnik ten, poprzez oddziaływanie z kateninami, negatywnie reguluje aktywność kadheryn w tworzeniu funkcjonalnych połączeń adhezyjnych.
Należy także zwrócić uwagę na rolę innych kadheryn w inwazji komórek nowotworowych. N-kadheryny zwiększają ruchliwość komórek nowotworowych. W dodatku obserwuje się wyraźną korelację między mniejszą ekspresją E-kadheryn, a zwiększonym poziomem N-kadheryn w komórkach nowotworowych. Prawdopodobnie podczas nowotworzenia następuje przełączenie kadheryn (ang. „cadherin switch”) z pro-adhezyjnych E-kadheryn na pro-migracyjne N-kadheryny. Taka „zamiana” kadheryn obserwowana jest również podczas embriogenezy (podczas gastrulacji) oraz podczas różnicowania się komórek mięśniowych. Stąd, molekularna analiza tego zjawiska może w znaczący sposób pomóc w zrozumieniu patogenezy komórek nowotworowych [2].
Wiele dowodów wskazuję, że obok kadheryn, również immunoglobulinowe CAMs (Ig-CAMs) są zaangażowane w proces migracji i inwazyjności komórek nowotworowych. Przykład stanowi tu Ig-podobny CAMs (CD66a) o aktywności supresorowej (ang. tumor suppressor). Ekspresja CD66a jest wyraźnie zmniejszona w wielu ludzkich nowotworach.
Jedną z Ig-CAMs, której zmniejszona ekspresja wyraźnie koreluje ze zdolnością komórek nowotworowych do inwazyjności jest N-CAM (ang. neural CAM). W komórkach nowotworowych różnego typu zaobserwowano przejście ze 120kDa isoformy do 140kDa lub 180kDa embrionalnej isoformy N-CAM. Molekularny sens tej zamiany nie jest jeszcze do końca poznany, przypuszczalnie ma to związek z różnym stopniem podstawienia kwasu sialowego w izoforamch N-CAM (kwas sialowy osłabia adhezję komórek).
U myszy Rip1Tag2 (Rip1Tag/N-CAM-/-, z wyłączonym genem kodującym N-CAM), zaobserwowano znaczące zmiany w organizacji tkanki oraz rozluźnienie jej struktury, gdyż brak N-CAM powodował nieprawidłową adhezję komórek do matrix zewnątrzkomórkowej. Wskazuje to na związek N-CAM z integrynami, będącymi receptorami dla składników macierzy. N-CAM bezpośrednio oddziałuje z b integrynami, wpływając w ten sposób migrację komórki. Wspomniane wcześniej małe GTPazy biorą udział w aktywacji i przekazywaniu sygnału przez integryny, zaś Rac1 jest niezbędny w czasie adhezji komórki do macierzy przy udziale N-CAM.
Co więcej w surowicy pacjentów z chorobą nowotworową, wykrywa się znaczące ilości ICAM-1, które prawdopodobnie oddziałują i blokują limfocyty T umożliwiając tym samym komórkom nowotworowym uniknięcie odpowiedzi ze strony układu immunologicznego [5].
Te informacje stanowią jedynie ślady, którymi należy podążać, aby w pełni zrozumieć współdziałanie różnych szlaków, w które zaangażowane są zarówno białka adhezyjne, białka skzieletu komórkowego jak i małe GTPazy, oraz udziału wszystkich tych czynników w inwazyjności komórek nowotworowych. Najbardziej interesujące jest, w jaki sposób „rozerwanie” kompleksu adhezyjnego zarówno między komórkami jak i komórkami a macierzą zewnątrzkomórkową przyczynia się do nabywania przez komórki nowotworowe potencjału metastatycznego. W związku z tym, że w procesie tym zaangażowane jest tak wiele białek adhezyjnych, a także ze względu na różnice w morfologii i funkcjonowaniu komórek nowotworowych wynikających z braku poszczególnych CAM, dokonano podziału na „aktywną” i „pasywną” metastazję (rys.1).
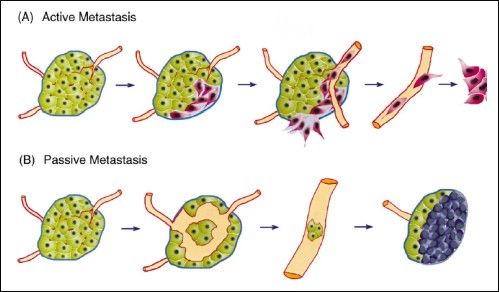
Rys 1. (A) aktywna metastazja związana z brakiem E-kadheryn biorących udział w adhezji między komórkami.(B) pasywna metastazja związana jest ze zmniejszoną ekspresją N-CAM (komórki pierwotnego guza nowotworowego przed osiągnięciem inwazyjności i potencjału metastatycznego przechodzą do naczyń krwionośnych i limfatycznych gdzie migrują do innych tkanek) [2].
Inwazja komórek nowotworowych na sąsiadujące a także odległe tkanki jest ułatwiona dzięki lokalnej proteolizie oraz dynamicznym oddziaływaniom między receptorami macierzy zewnątrzkomórkowej, białkami adhezyjnymi oraz szkieletem aktynowym. Główną rodziną receptorów ECM są integryny, białka adhezyjne regulujące szlaki sygnałowe kontrolujące dynamikę cytoszkieletu aktynowego, ruch, różnicowanie się i wzrost komórki. Mogłoby się wydawać, że poziom integryn w komórkach nowotworowych będzie niższy w porównaniu z komórkami normalnymi, na skutek rozerwania połączeń między komórkami a ECM (hemidesmosomy), budowanych przez integryny,. Tymczasem ekspresja integryn pozostaje na tym samym poziomie, nie tworzą one jednak hemidesmosomów, lecz asocjują z filamentami aktyny. Integryny w komórkach nowotworowych zlokalizowane są w lamelopodiach, filopodiach i włókienkach naprężeniowych (ang. stress fibers), które tworzone są podczas migracji i generowaniu ruchu komórki. Co ciekawe integryny nie są niezbędne do migracji komórek nowotworowych. Jednakże ich obecność wyraźnie zwiększa potencjał metastatyczny nowotworu w porównaniu z migrującymi komórkami ze zmniejszonym poziomem integryn.
Ponadto integryny, szczególnie a6b4 (alfa-6-beta-4), stymulują kinazę 3-OH fosfoinozytolu, (PI3-K). Aktywność tego enzymu jest kluczowa dla inwazji komórek nowotworowych. PI3-K aktywuje z kolei białko supresorowe Ras, a to pociąga za sobą szereg reakcji bezpośrednio wpływających na migrację komórek nowotworowych [3]. W rzeczywistości, poziom różnych integryn w różnych komórkach nowotworowych na poszczególnych poziomach inwazyjności jest zróżnicowany, na przykład mniejszą ekspresję integryn a2b1 (alfa-2-beta-1) oraz a5b1 (alfa-5-beta1) zaobserwowano w nowotworze piersi [5].
Mimo, że badania nad białkami adhezyjnymi (CAMs) rzucają nowe światło na proces migracji komórek nowotworowych, należy być świadomym, że odkrycia te stanowią na razie „wierzchołek góry lodowej” w zrozumieniu nowotworzenia oraz mechanizmu inwazji i metastazji nowotworów.
Literatura:
1. Takatsugu Okegawa, Rey-Chen pong, Yingming Li, Jer-Tsong Hsieh; The role of cell adhesion molecule in cancer progression and its application in cancer theraphy; Acta Biochimica Polonica; Vol.51 No.2 (2004).
2. Ugo Cavallaro, Gerhard Christofori; Cell adhesion in tumor invasion and metastasis: loss of the glue is not enough; Biochimica et Biophysica Act 1552 (2001).
3. Arthur M. Mercurio, Isaac Rabinovitz; Towards a mechanistic understanding of tumor invasion- lessons grom the a6b4 integrin; Cancer Biology Vol.11 (2001).
4. Kenneth M Yamada, Benjamin Geiger; Molecular interactions in cell adhesion
complexes; Current Opionion in Cell Biology 9 (1997).
5. Ahmad, I.R. Hart; Mechanism of metastasis; Critical Reviews in Oncology/Hematology 26 (1997).
6. Wykłady: Struktura i funkcja błon biologicznych (IV rok), Molekularna Organizacja Komórki (III rok), prof. A. Sikorski
