Liposomy Stealth
Michał Surma | 2006-04-26
Liposomy są to zamknięte struktury pęcherzykowe zdolne do zamykania roztworów wodnych. Są one zbudowane z jednej do kilkunastu koncentrycznie ułożonych dwuwarstw lipidowych, analogicznych do lipidowego zrębu błon biologicznych. Możliwość ich powstawania wynika z właściwości amfifilowych lipidów dwuwarstwy i tym samym samoorganizacji ich w struktury dwuwarstwowe w roztworach wodnych, które to dwuwarstwy wykazują, zgodnie z zasadą najniższej energii, tendencje do tworzenia pęcherzyków. Zaobserwowane po raz pierwszy przez Lehmanna, podczas uwadniania fosfolipidów i nazwane: "sztucznymi komórkami".
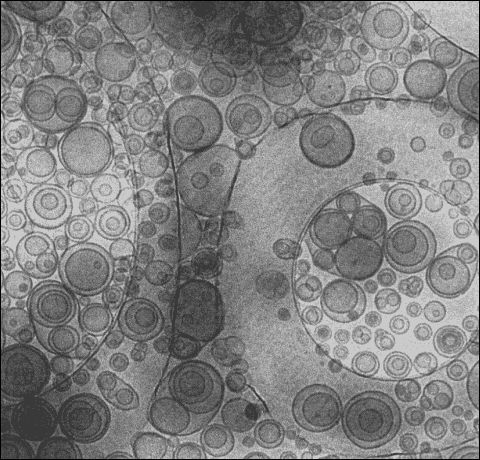
Rys. 1. Przykładowe liposomy [1].
Stosując kryterium wielkości i warstwowości liposomów, wyróżniamy następujące ich kategorie [2, 3, 4]:
- liposomy wielowarstwowe - MLV (multi lamellar vesicles) – zbudowane z kilku do kilkuset warstw lipidowych, mające średnicę w granicach od 300 nm – 20 μm (widoczne pod mikroskopem świetlnym);
- duże jednowarstwowe liposomy - LUV (large unilamellar vesicles) - duże pęcherzyki otoczone pojedynczą błoną lipidową, mające średnicę od 80 do1000 nm;
- małe jednowarstwowe liposomy - SUV (small unilamellar vesicles) o średnicy 20-80 nm;
- olbrzymie jednowarstwowe liposomy - GUV (giant unilamellar vesicles) - osiągające 1-2 μm średnicy.
Powstawanie tych struktur z lipidów opisują dwa główne modele:
- model "pączkowania" - pęcherzyki powstają w czasie stopniowego uwadniania suchych lipidów błonowych. Taki suchy film lipidowy, powstały na ściankach naczynia po odparowaniu rozpuszczalnika, ma strukturę warstwową, identyczną z dwuwarstwą. Sądzi się nawet, że mimo pozornej "suchości" dalej zachowuje ona swoją parakrystaliczną strukturę, dzięki trwale związanej z nim wodzie. Podczas uwadniania takiego filmu, cząsteczki wody eksplorują go, wnikają pomiędzy poszczególne dwuwarstwy, powodując ich rozpulchnienie, rozdzielenie, a następnie "pączkowanie" zaczątków pęcherzyków. Pęcherzyki dzięki delikatnemu wytrząsaniu odrywają się, a jako że powstały z wielowarstwowego filmu lipidowego są one typu MLV. Konwersję MLV do SUV można przeprowadzić dostarczając energię do układu. Najczęściej wykorzystuje się do tego celu sonikację, przeciskanie przez membrany o określonej średnicy porów (kalibracja) czy prasę Frencha. LUV z kolei uzyskuje się w wyniku kontrolowanej fuzji SUV technikami zamrożeniowo-rozmrożeniowymi czy też dehydratacyjno-rehydratacyjnymi [3, 4]. W tym miejscu warto wspomnieć jeszcze o tak zwanych GUV. Są to duże liposomy o rozmiarach do kilkuset mikrometrów. Jedną z metod ich otrzymywania jest technika elektroformacji, polegająca na przyłączeniu prądu zmiennego do specjalnych elektrod, leżących około 1 mm od siebie, na których znajduje się suchy film lipidowy [5].
- model „fuzji fragmentów dwuwarstwy lipidowej” - intermediatem na drodze powstawania liposomów są zasadniczo planarne fragmenty dwuwarstwy, które po fuzji dają zamknięte pęcherzyki [3, 4].
Liposomy Stealth
Stosunkowo niedawny wynalazek w dziedzinie technologii liposomowych. Nazywane są z racji zmniejszonej "wykrywalności" dla układu immunologicznego, a co za tym idzie przedłużonego czasu krążenia we krwi. W taki sposób lek w nich zawarty może być obecny w ustroju dłużej, wymagana jest zatem jego mniejsza jednorazowa dawka. W połączeniu z "adresowaniem" liposomów, liposomy Stealth są nowoczesnym narzędziem terapeutycznym.
By uczynić liposomy "niewidzialnymi", "najeża" się ich powierzchnie resztami cukrowymi (glikolipidy czy gangliozydy), lub używa się glikolu polietylenowego, co utrudnia opłaszczenie takich liposomów przez opsoniny.
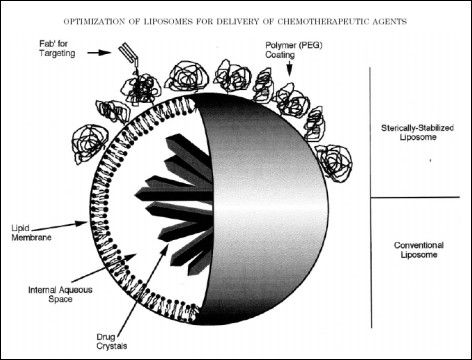
Rys. 3. Porownanie budowy liposomu zwyklego z liposomem typu stealth. [6]
Liposomy Stealth w porównaniu do zwykłych liposomów mają zniwelowane całkowicie lub w dużym stopniu takie wady jak [7]:
- szybkie przechwytywanie przez system endoretikularny (RES);
- w związku z tym krótki czas cyrkulacji we krwi;
- gwałtowne wychwytywanie przez komórki wątroby i śledziony, co zmniejsza ilość liposomów docierających do celu.
Ich znaczącymi zaletami są:
- dostarczanie leków do miejsc docelowych w dużej ilości, co chroni lek przed degradacją, a organizm przed interakcjami z lekiem poza miejscem docelowym;
- lek trafia do miejsca przeznacznia bez pośrednictwa układu RES;
- w połączeniu z kontrolowanym uwalnianiem leku, mogą lek uwalniać szybko jak i powoli;
- dodatkowo można kontrolować uwalnianie leku w danym miejscu poprzez modyfikacje błony liposomów;
Tab.1. Porównanie liposomów zwykłych ze Stealth [8].

Ładowanie i uwalnianie leku w liposomach Stealth na przykładzie doksorubicyny (ładowanie gradientem pH)
Klasyczne liposomy cechuje czas półtrwania rzędu kilku minut, liposomy Stealth kilku godzin. Tak długi czas półtrwania, związany także z niskim wyciekiem leku, uzyskuje się stosując unikalne metody ładowania liposomów Stealth, które prócz wysokiej wydajności ładowania zapewniają także utrzymywanie leku we wnętrzu przez dłuższy czas. Taką metodą jest ładowanie gradientem pH. Metoda ta dotyczy nie wszystkich leków, ale wyłącznie tych, które rozpuszczają się w fazie wodnej, oraz są słabymi kwasami lub zasadami.
W liposomach najpierw zamyka się siarczan amonu, a środowisko zewnętrzne wymienia się na np. sól fizjologiczną i roztwór leku. W takich warunkach dysocjujący siarczan amonu wewnątrz liposomów, po wniknięciu obojętnej formy leku, utworzy jon siarczanowy oraz amonowy. Ten jon oddając swój proton słabej zasadzie – doksorubicynie, utworzy amoniak, który z łatwością opuszcza liposom. Pozostający wewnątrz siarczan, wpływając na równowagę dysocjacji wody zakwasi środowisko, a sam lek ulegnie jonizacji, co uniemożliwi jego wyciek. Gradient podtrzymuje lek w środku nawet do 15h po zaaplikowaniu do krwioobiegu. Po tym czasie jest zwykle zniesiony, a lek powoli wycieka [6, 9].
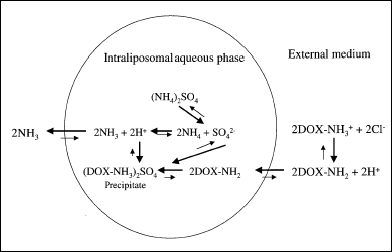
Rys.4. Zamykanie leku w liposomie za pomocą gradientu pH [6].
Inną użyteczną metodą ładowania liposomów Stealth jest ładowanie metodą kompleksowania z jonami metalu (np. manganem) [10].
Uwalnianie leku z wnętrza liposomu na przykładzie doksorubicyny
Aby doszło do zwolnienia leku przez liposom, musi zostać zniesiony gradient pH. Jednym ze sposobów jest podziałanie na miejsce zgromadzenia liposomów (tkanka nowotworowa) temperaturą około 40 0C, co prowadzi do gwałtownej destabilizacji błony (zwiększenie ruchliwości, zmniejszenie upakowania), a tym samym do jej nieszczelności.
Innym sposobem na zniesienie gradientu pH jest użycie jonoforów np. nigerycyny [6].
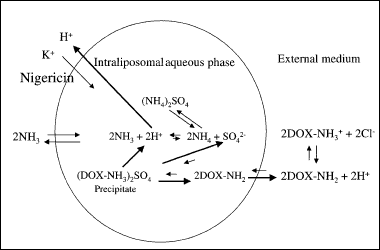
Rys. 5. Uwalnianie leku z wnętrza liposomu na skutek zniesienia gradientu stężeń [6].
Techniki stosowane do przedłużenia czasu cyrkulacji liposomów Stealth
Jednym ze sposobów przedłużenia czasu cyrkulacji jest usztywnienie dwuwarstwy poprzez wprowadzenie cholesterolu lun sfingomieliny. Czas półtrwania może wtedy wzrosnąć do 10h.
Zmniejszenie lub nawet zniesienie osponizacji czy opłaszczania przez białka immunologiczne uzyskujemy poprzez usianie powierzchni liposomu polimerami, związanymi z lipidami błony. Najpowszechniej używa się glikolu polietylenowego PEG. Podczas takiej modyfikacji znaczenie ma nie tylko długość łańcucha polimeru, ale także jego rozkład na powierzchni.
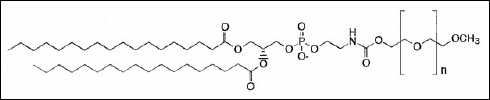
Rys.6. DSPE-PEG
Tab.2. Rodzaj utworzonej struktury na powierzchni liposomu w zależności od stosunku jego długości (R) do odległości między miejscami przyczepu do powierzchni (gęstość usiania D) [7].

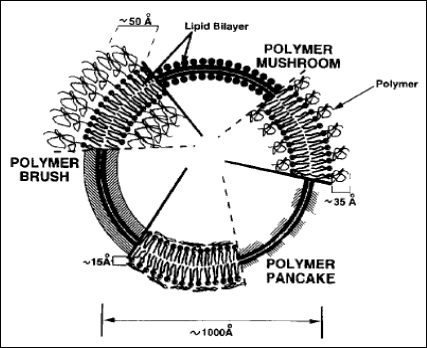
Rys.7. Różne struktury tworzone przez PEG na powierzchni liposomu stealth [7].
Błona liposomu jest „ekranowana” przed interakcjami z np. białkami osocza tym skuteczniej, im gęściej usiana jest polimerem, im jest on dłuższy, a łańcuchy jego ruchliwsze. Prowadzi to do wzrostu dynamiki tego płaszcza polimerowego, zmian konformacyjnych, które są impulsem do odepchnięcia obcych cząsteczek.
Białka wiążą się do liposomu oddziaływaniami niekowalencyjnymi, jak siły van der Waalsa czy interakcje hydrofobowe. PEGylowane liposomy mają, wobec tego, znacznie obniżoną możliwość wiązania białek, ale także znacznie trudniej adhezować im do powierzchni komórek. Badania wykazują, że PEGylowanie rzędu 5mol% zapobiega przyłączaniu się białek nawet o tak dużych stałych asocjacji, jak streptawidyna wobec biotynylowanych liposomów [7].
Liposomy PEGylowane są także bardziej odporne na fuzję, a ponadto skrajne grupy metoksy- PEGu mogą służyć jako miejsce kowalnecyjnego wiązania przeciwciał kierujących liposom w konkretne miejsce (adresowanie).
PEG obok swych zalet posiada także kilka zasadniczych wad, co znacznie ogranicza jego zastosowania w liposomach Stealth. Charakteryzuje sie mianowicie słabą hydrofobowością, co prowadzi do jego stopniowego uwalniania z błony, a więc do zaniku warstewki ochronnej wokół liposomu i obniżeniu czasu półtrwania.
Przechowywanie liposomów Stealth – liofilizacja
Medyczne zastosowanie liposomów Stealth na szeroką skalę wiążę sie z potrzebą ich przechowywania w stanie nadającym się do natychmiastowego użycia przez co najmniej rok – 2 lata. Jedną z metos takiego utrwalania liposomów jest ich liofilizacja. W czasie liofilizacji liposomy chronione są przed defektami poprzez dodanie substancji o charakterze krioprotektantów, jak np. disacharydy. Mimo wszystko, liposomy ulegają uszkodzeniom podczas ponownego uwadniania, co zmniejsza ich trwałość i obniża sprawność, oraz prowadzi do większego wycieku leku. Uszkodzenie jest tym większe, im więcej razy liposom poddaliśmy cyklowi liofilizacja/rehydratacja [11].
Zastosowanie liposomów Stealth w leczeniu chorób płuc – przykład
W większości agresywnych terapii największym problemem są skutki uboczne stosowanych leków. Zastosowanie liposomów Stealth pozwala na wyeliminowanie, czy też drastyczne obniżenie tych efektów, a dodatkowo pozwala na stosowanie niższych dawek leku, przy jednoczesnym przedłużonym czasie jego krążenia. Liposomy muszą być oczywiście odpowiednio stabilne, szczelne oraz uwalniać swą zawartość powoli w określonym miejscu, by jak najbardziej przedłużyć czas ekspozycji na lek. Jak pisano wyżej, szczelność uzyskujemy uszczelniając błonę, natomiast przedłużony czas krążenia modyfikując liposomy egiem, czy gangliozydami.
W opisanym doświadczeniu, po pomiarach szczelności liposomów wobec znakowanej radioaktywnie metyloglukozy, największą szczelność wykazały pęcherzyki o składzie PC:CHOL w stosunku 2:1,5. Podwyższanie zawartości cholesterolu powodowało wzrost agregacji liposomów. Dodatkowo liposomy otoczone płaszczem z o-stearyloamylopektyny (O-SAP, cukrowiec) wykazywały jeszcze 5% wzrost szczelności. Sprawdzono także wpływ domieszek DCP (dicetylofosforan o ładunku ujemnym) i SA (stearyloamina o ładunku dodatnim). DPC powodowało 20% wzrost szczelności, natomiast SA, aż 50% spadek szczelności błony wobec niemodyfikowanych liposomów [12].
Takie liposomy o różnym składzie podawano myszom i badano ich akumulację w tkance płuc po zadanym czasie.
Tab.3. Kumulacja liposomów w tkankach płuc [12].
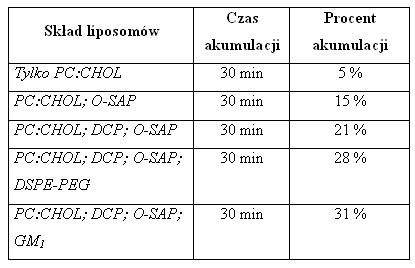
Dodatkowo wcześniejsza, jednogodzinna immunizacja organizmu liposomami podnosiła ilość zakumulowanych liposomów w tkankach płuc o 10 % (osłabienie odpowiedzi układu RES).
Stabilność liposomów Stealth utrzymywała się do 96 godzin od podania dożylnego i do tego też czasu powoli zwalniały one lek ze swego wnętrza. Wykazywały przez to mniejszą cytotoksyczność w stosunku do leku podanego samodzielnie o 48 % [13].
Wydłużenie czasu półtrwania tłumaczą małe rozmiary tych liposomów (do 200nm) oraz zastosowanie w ich składzie O-SAP, który tworzy na ich powierzchni płaszcz ochronny, podobnie jak ujemnie naładowany DCP, GM1 (odpycha inne, powierzchniowo ujemne liposomy oraz białka układu immunologicznego o ładunku ujemnym). GM1 dodatkowo zwiększa hydrofilowość powierzchni liposomów, przez co są one trudniej wykrywane przez układ RES, czy białka opsonizujące. Podobną rolę pełni także PEG, który jak pisano wcześniej, tworzy także zawady steryczne dla próbujących się przyłączyć białek.
Są znane wcześniejsze badania z użyciem siarczanu dekstranu i palmitynianu metylu jako blokerów układu RES, ale zaniechano ich stosowania z powodu wysokiej ich toksyczności.
Przegląd liposomów typu Stealth
- SOY (PC/CHOL/PEG-DSPE) - stosowane są w leczeniu nowotworów MC2A, MC2B, MC65;
- PC z 10 mol% PE-PEG 5000 - czas cyrkulacji do 24 godzin!;
- DSPE/CHOL (2:1) z PEG 1900 mg/ml – PEG, zgodnie z wcześniej przedstawionymi mechanizmami, odpycha swoimi łańcuchami (wystającymi na 50Ǻ poza obręb błony) białka cytoplazmatyczne i komórki patogenne;
- nasycone fosfolipidy i sfingomielina z gangliozydami w roli osłony – trudno wyłapywane przez komórki śledziony, zastosowanie cholesterolu wzmaga wyłapywanie tych liposomów przez wątrobę, ale obniża przez śledzionę;
- PC/SM/CHOL/ GM1 (stosunek molowy 1:1:1:0,14) – charakteryzują się redukcją wypływu roztworów z wnętrza liposomu i mniejszym opłaszczanie przez opsoniny [13]
Literatura i źródła ilustracji
[1] http://www.bioteach.ubc.ca/Bio-industry/Inex/graphics/liposomes.gif
[2] A. Kozubek Wstęp do technologii liposomowych Wrocław, (2002)
[3] D.D. Lasic Liposomes from Physics to Applications Elsevier, (1995) Amsterdam
[4] A. Kozubek, A.F. Sikorski, J. Szopa Molekularna organizacja komórki. Część II. Lipidy, liposomy i błony biologiczne. Wydawnictwo Uniwersytetu Wrocławskiego, (1993) Wrocław
[5] M.I. Angelova, S. Soleau, P. Meleard, J.F. Faucon, P. Bothorel Preparation of giant vesicles by external AC electric field. Kinetics and applications. Progr. Colloid. Polym. Sci. 89 (1992) 127-131
[6] Y. Barenholz Liposome Application: Problems And Prospects. Current Opinion In Colloid & Interface Science 6 (2001) 66-77
[7] D. Lasic B. Ceh Stealth® Liposomes: From Theory To Product. Advanced Drug Delivery Rewievs 24 (1994) 165-177
[8] A. A. Gabizon Stealth Liposomes And Tumor Targeting: One Step Further In The Quest For The Magic Bullet. Clinical Cancer Research 7 (2001) 223–225
[9] B. Ceh, D.D. Lasic A Rigorous Theory of Remote Loading of Drugs into Liposomes: Transmembrane Potential and Induced pH-Gradient Loading and Leakage of Liposomes
J. of Colloid & Interface Science 185 (1997) 9-18
[10] B.C.L. Cheung, T.H.T. Sun, J.M. Leenhouts, P.R. Cullis Loading of doxorubicine into liposomes by forming MN+2 – drug complexes Biochim. et Biophys. Acta 1414 (1998) 205-216
[11] K.R. Ward, H.O. Alpar, G.D.J. Adams, K.N. Atuah, W.J. Irwin Effects of lyophylisation on the formation and stability of stealth liposomes
[12] P. Deol, G. K. Khuller, K. Joshi Therapeutic Efficacies Of Isoniazid And Rifampin Encapsulated In Lung-Specific Stealth Liposomes Against Mycobacterium Tuberculosis Infection Induced In Mice. Antimicrobial Agents And Chemotherapy (1997) 1211–1214
[13] D. B. Kirpotin, D. Papahadjopoulos Optimizing Liposomes For Delivery Of Chemotherapeutic Agents To Solid Tumors. Pharmacological Reviews Pharmacological Reviews 51 (1999)
------
Autor artykułu jest członkiem:
*Przybysz* Studenckie Koło Naukowe Biotechnologów Uniwersytetu Wrocławskiego
