Proteazy ICE w programowanej śmierci komórki
Michał Surma | 2006-04-06
ICE (Interleukin Converting Enzyme) jest to enzym konwertujący interleukine-1β z jej formy pro- do dojrzałego produktu. Sam enzym jest syntetyzowany w formie 45kDa prekursora (p45), który jest procesowany do do polipetydów 20kDa i 10kDa (p20 i p10), poprzez ściśle określone cięcia od strony C’-końca przy resztach asparaginianowych. Struktura krystaliczna dojrzałego białka ujawnia, że jest ono tetrametrem złożonym z dwóch heterodimerów, zawierających p20 i p10 każdy. Miejsce aktywne jest rozciągnięte pomiędzy nimi.
 ICE jest protoplastą nowej klasy enzymów proteolitycznych zwanych ‘aspazami’, ponieważ tną one substrat od C’-końca przy resztach asparaginianowych. Proteazy typu do którego należy ICE mają wspólną cechę w postaci sekwencji QACRG w miejscu aktywnym, która jest konserwatywna dla tej rodziny proteaz.
ICE jest protoplastą nowej klasy enzymów proteolitycznych zwanych ‘aspazami’, ponieważ tną one substrat od C’-końca przy resztach asparaginianowych. Proteazy typu do którego należy ICE mają wspólną cechę w postaci sekwencji QACRG w miejscu aktywnym, która jest konserwatywna dla tej rodziny proteaz.
Dowody na udział proteaz ICE w programowanej śmierci komórki
Jest kilka dowodów przemawiających za hipotezą kluczowej roli proteaz ICE w programowanej śmierci komórek. Dowody te są zebrane z różnych poziomów mechanizmów molekularnych w komórce i uzupełniają się nawzajem. O ile każdy z nich osobno mógłby być zakwestionowany, o tyle zebrane razem świadczą wymownie o nieprzypadkowej funkcji proteaz ICE w programowanej śmierci komórek.
Pierwszym z nich jest odporność mysich komórek ICE-null (znokautowany gen) na programowaną śmierć, indukowaną antygenem FAS. Podobną odporność wykazały komórki w których aktywność genu ICE wyciszono nadekspresjonując w nich antysensowne do jego transkryptu mRNA.
Z kolei nadekspresja proteaz typu ICE wywołuje apoptozę w komórkach różnego typu. Jest to jednak słaby dowód, gdyż podanie nawet takich proteaz jak trypsyna czy chymotrypsyna, także może wywołać apoptozę.
Trzecim dowodem jest aktywność inhibitorów wirusowych proteaz ICE – CrmA i p35, jako blokerów programowanej śmierci komórek.
CrmA jest białkiem wirusa krowianki, które jest silnym inhibitorem proteaz ICE, co po jego podaniu, skutkuje zablokowaniem śmierci komórki indukowanej antygenem FAS oraz czynnikiem nekrozy nowotworu (TNF).
P35, z kolei, jest białkiem baculowirusa także inhibujacym ICE (oraz kilka innych proteaz tego typu), co ponownie skutkuje programowaną śmierć komórki.
Aktywność blokującą śmierć komórki wykazano także dla sztucznych inhibitorów enzymu ICE. Są to polipeptydy powstałe na bazie naturalnego substratu (interleukiny) w których zmodyfikowano kluczowe reszty aminokwasowe tak, żeby polipeptydy te były silnymi inhibitorami enzymu.
Badacze postawili sobie pytanie czy istnieją wobec tego endogenne inhibitory proteaz ICE. Co ciekawe taką właściwość wykazywały pewne izoformy samego ICE, działając jako pewnego rodzaju proteolityczne regulatory. I tak, forma ICE-ε asocjuje z podjednostką p20 ICE, co w rezultacie prowadzi do katalitycznie nieaktywnego produktu. Z kolei inny fragment ICE – ICH-1S, czyli krótki, także miał aktywność hamująca wobec swojego nie pociętego odpowiednika ICH-1L. Obydwa przypadki wskazują na dominację inhibicji własnymi fragmentami proteolitycznymi. Czyli każdy enzym ICE posiada w swojej sekwencji także swój inhibitor, który ulega aktywacji po jego wycięciu.
Czwartym dowodem jest zaobserwowanie procesowania ICE do formy dojrzałej, krótko po otrzymaniu „sygnału śmierci” (aktywacji szlaku poprzez receptor FAS czy TNF). Taka mobilizacja tego enzymu może świadczyć o jego kluczowej roli w procesie śmierci komórki.
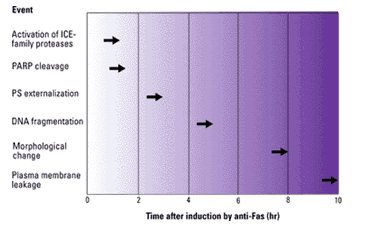
Rys.2. Kolejność czasowa wydarzeń podczas zaindukowanej apoptozy.
Kolejnym dowodem jest cięcie przez ICE szeregu białek we wczesnej fazie apoptozy. Do ciętych białek, prócz pro-interleukiny, należą także laminy, β-aktyna, rybonukleopreteina U1, składniki systemu mikrofilamentów i inne, których rola w apoptozie jest znana i udowodniona.
Ostatni dowód wynika z analizy genów nicienia C.elegans, które regulują programowaną śmierć komórki. Są to geny ced-3, ced-4, które są wymagane do śmierci komórki oraz gen ced-9 (strukturalny i funkcjonalny homolog bcl-2), który jest ich antagonista i blokuje śmierć komórki.
ced-4 nie ma znanych ssaczych homologów ani poznanej funkcji, ale ced-3 wykazuje bardzo wysoką homologię właśnie z genem ICE.
Proteazy ICE w kaskadach sygnałowych apoptozy
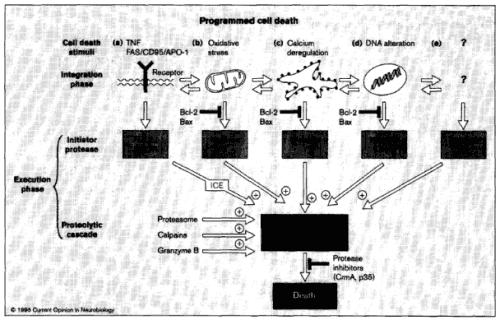
Rys. 3. Prawdopodobne modele aktywacji programowanej śmierci komórki. Śmierć taka może być następstwem uruchomienia różnych mechanizmów poprzez (a) otrzymanie sygnału zewnątrzkomórkowego lub z (b, c) z organelli, lub też z (d) jądra, a także (e) wciąż nieznanych źródeł. Proteazy ICE zdają się brać udział w szlakach przekazywania sygnału w fazie wykonawczej po integracji sygnału.
Wiele dowodów wskazuje na to, że proteazy ICE działają w kaskadzie poniżej białek rodziny Bcl-2 (np. Bax czy Bak). Nadekspresja tych białek może powstrzymać apoptozę komórki, poprzez zahamowanie szlaków. Jednak w przypadku apoptozy indukowanej sygnałem zewnątrzkomórkowym białka Bcl-2 wykazują słabą inhibicję szlaku i wtedy zahamowanie apoptozy można uzyskać właśnie dzięki inhibitorom ICE.
Aktywacja ICE poprzez sygnał zewnątrzkomórkowy zachodzi poprzez kolejnego reprezentanta rodziny ICE: FLICE (FADD-like ICE), którego domena jest strukturalnie homologiczna do FADD (FAS-associating protein with death domain). Po aktywacji receptora przez FAS czy TNF, wiąże się on do „domeny śmierci” cząsteczki FADD, która (we wciąż niepoznany sposób), z kolei wiąże i aktywuje FLICE. FLICE wtedy stymuluje kaskadę złożoną z kolejnych przedstawicieli rodziny. Używając specyficznych inhibitorów dowiedziono że ta aktywacja także jest wieloetapowa.
Znalezienie kolejnej proteazy ICE (FLICE) pośredniczącej na szlaku apoptotycznym pomiędzy receptorem a dalszymi jego składnikami świadczy o niezmiennie ważnej roli tej proteazy w podobnych procesach, a także ujawnia nam pewne jej cechy, które są niezbędne do pełnienia tej funkcji. I tak, proteazy te są i muszą być zlokalizowane w kluczowych miejscach szlaku. Powinny być łatwo wiązane przez receptor, poprzez specyficzną domenę oraz po związaniu wykazywać zdolność do aktywacji poprzez auto- lub transproteolizę. Oczywiście te cechy nie są wyjątkowe tylko dla ICE, ale także dla szeregu innych proteaz, które biorą udział w kaskadach apoptotycznych, co także jest dowodem na to, że ICE nie odbiegają od przyjętego wizerunku takiej proteazy.
Jak ICE zabijają komórkę?
Pomimo, że miejsce ICE w kaskadzie apoptotycznej jest udowodnione i nieźle poznane, wciąż nie wiadomo jak właściwie te proteazy doprowadzają do śmierci komórki. Wydaje się, że ich rola na tym polu to proteoliza różnych składników komórki, która doprowadza do jej śmierci. Jednak pomimo poznania wielu substratów dla ICE, wciąż nie wiadomo, czy utrata przez nie funkcji w wyniku cięcia przez ICE jest wystarczająca dla śmierci komórki.
Co ciekawe, zaobserwowano, że ceramid, który jest znanym mediatorem drugorzędowym w indukcji apoptozy, wymaga aktywności proteaz ICE w komórkach muszki owocówki, by pełnić swą rolę. Czy działa to na zasadzie aktywacji sfingomielinazy (enzymu produkującego ceramidy) przez ICE? Wciąż nie wiadomo. Jednak odnalezienie takiego mediatora jak ceramid, który działa poniżej ICE w kaskadzie szlaku apoptotycznego może wskazywać, że ICE nie są finalnym wykonawcą „wyroku śmierci”, a tylko kolejnym składnikiem kaskady.
Na podstawie i z wykorzystaniem:
[1] Martinom, J-C., Sadoul E., „ICE-like proteases execute the nauronal heath program” Curr. Opinion in Neurobiol. 6, 1996;
[2] Wilson, K.P., Black, J.A., Thomson, J.A., Kim, E.E., Griffith, J.P., Navia, M.A., Murcko, M.A., Chambers, S.P., Aldape, R.A., Raybuck, S.A., al., et „Structure and mechanism of interleukin-1 beta converting enzyme.” Nature 370, 1994;
[3] http://www.clontech.com/clontech/archive/JUL97UPD/images/Apoptosis.gif ;
------
Autor artykułu jest członkiem:
*Przybysz* Studenckie Koło Naukowe Biotechnologów Uniwersytetu Wrocławskiego
