Białka zmodyfikowane przez ubikwitynę widać *na żywo*
Filip Gołębiowski | 2004-10-15
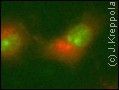 Naukowcom udało się zobaczyć w żywych komórkach umieszczonych pod mikroskopem, białka które zostały "oznaczone" przez ubikwitynę. Poprzednio obserwacja ich, oraz co za tym idzie powiązanych z ubikwitynacją procesów, była możliwa wyłącznie "in vitro".
Naukowcom udało się zobaczyć w żywych komórkach umieszczonych pod mikroskopem, białka które zostały "oznaczone" przez ubikwitynę. Poprzednio obserwacja ich, oraz co za tym idzie powiązanych z ubikwitynacją procesów, była możliwa wyłącznie "in vitro".
Technologię, której nazwę można by przetłumaczyć jako pośredniczone przez ubikwitynę fluorescencyjne dopełnianie (ang. ubiquitin-mediated fluorescence complementation) opublikowali w najnowszym numerze czasopisma Proceedings of the National Academy of Sciences (PNAS).
Polega ona na obserwacji światła fluorescencji powstałego po przyłączeniu się do ubikwityny białka, którego interakcje z nią badali (białka Jun).
Było to możliwe, ponieważ do każdej z oddziałujących cząsteczek dołączyli po jednym komplementarnym fragmencie fluorescencyjnego białka. Kiedy dochodzi do interakcji obu cząsteczek, dodane, dopełniające się fragmenty białkowe, tworzą funkcjonalną, zdolną do emisji światła cząsteczkę białka, dzięki czemu można światło przez nią emitowane obserwować w mikroskopie fluorescencyjnym.
Pozwoliło to badaczom na ujrzenie miejsca powstania i przemieszczania się badanej cząsteczki, którą było białko Jun w komórce. Jest ono odpowiedzialne za regulację transkrypcji genów i wzrost komórki. Dzięki metodzie fluorescencyjnego dopełniania zaobserwowano przemieszczanie się Jun z jądra do lizosomów. Funkcja lizosomów polega m.in. na hydrolizie (degradacji) różnych związków organicznych w tym białek.
Ubikwityna jest małym, zawierającym 76 aminokwasów białkiem, o którym wiadomo było, że jest zaangażowane w oznaczanie (ubikwitynację) białek, które mają ulec degradacji. Z tego powodu mówi się o "pocałunku śmierci", który daje białku przeznaczonemu do zniszczenia. C-końcowa domena ubikwityny łączy się z łańcuchem bocznym lizyny docelowego białka, co jest sygnałem dla komórki, że należy je zniszczyć. Dokonuje tego proteasom, duża wewnątrzkomórkowa proteaza.
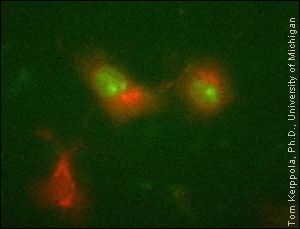 Jednak, jak się wydaje, nie jest to jedyne zadnie ubikwityny, która może być zaangażowana w inne funkcje komórki, takie jak transport białka. Chęć ich poznania przyświecała naukowcom wykonującym powyższy eksperyment.
Jednak, jak się wydaje, nie jest to jedyne zadnie ubikwityny, która może być zaangażowana w inne funkcje komórki, takie jak transport białka. Chęć ich poznania przyświecała naukowcom wykonującym powyższy eksperyment.
Tegoroczną nagrodę Nobla w dziedzinie chemii otrzymali trzej biochemicy: Aaron Ciechanover, Avram Hershko i Irwin Rose właśnie za badania nad procesem kontrolowanej degradacji białek w komórkach, w którym bierze udział białko ubikwityna.
Na fotografii:
Zielony kolor wskazuje położenie samego białka Jun w jądrze komórkowym, kolor czerwony zaś już połączonego z ubikwityną w lizosomie, w cytoplaźmie.
Źródło: University of Michigan Medical School
Komentarze
nati | 2004-10-16 00:00:00
Filipie! Bardzo podoba mi się strona:) Jestem pod wrazeniem:)
