Epotilony - alternatywa dla taksonów w leczeniu nowotworów
Barbara Lachowicz | 2008-01-11
Mikrotubule odgrywają istotną rolę w utrzymywaniu kształtu komórek, podziałach komórkowych, rozmieszczeniu i ruchu organelli komórkowych, a także pęcherzyków cytozolowych i białek. Kluczowymi w utrzymaniu prawidłowej struktury tych białkowych polimerów są procesy polimeryzacji i depolimeryzacji przebiegające na końcach filamentów. Ustanowienie mikrotubul jako potencjalnego celu w niszczeniu komórek nowotworowych doprowadziło do dużej intensyfikacji poszukiwań substancji wpływających na ich organizację.
Taksany i alkaloidy Vinca to dwie rodziny chemioterapeutyków, których mechanizm działania opiera się na interakcji z podjednostkami tubuliny i w efekcie zaburzeniu procesu formowania jej polimerów. Komórka zatrzymana wówczas zostaje w fazie G2/M cyklu komórkowego, co z kolei skutkuje wprowadzeniem jej na szlak apoptotyczny. Spośród taksanów najszerzej używanymi są paklitaksel i docetaxel. Wykazują one dużą skuteczność, o czym świadczy fakt, że są w stanie wywołać odpowiedź w 32%-68% przypadków. Jednakże zadowalającym efektom terapeutycznym towarzyszą nasilone skutki uboczne, jak również nabywanie oporności lekowej. Ostatni aspekt nie został jak dotąd dostatecznie poznany. Wiadomo na pewno, że wywołuje go zespół czynników, takich jak mutacje w podjednostce tubuliny i nasilona ekspresja oddziałujących z nią białek, oraz nadekspresja glikoproteiny P, będącą jednym z głównych białek zaangażowanych w mechanizmy oporności wielolekowej (MDR, multidrug resistance). Starania mające na celu opracowanie leku działającego podobnie jak taksol, ale bardziej aktywnego zwróciło uwagę badaczy na odkrytą na początku lat 90-tych cząsteczkę epotilonu. Zasada działania jest tutaj identyczna, jak w przypadku taksolu – promocja polimeryzacji tubuliny uniemożliwia prawidłowy rozpad wrzeciona podziałowego i w efekcie zablokowany zostaje podział komórki, co prowadzi do apoptozy.
Epotilony po raz pierwszy wyizolowane zostały w 1993 roku z powszechnie występującej glebowej miksobakterii Sorangium cellulosum zdolnej do degradacji celulozy. Wykazywały niezwykle wąskie spektrum właściwości przeciwgrzybiczych (wyłącznie przeciw Mucor hiemalis). Były zbyt toksyczne, by mogły zostać wykorzystane jako środek przeciwgrzybiczy, jednak obiecujące okazało się odkrycie, że ich cytotoksyczność jest podobna do powodowanej przez taksol. Co więcej epotilon łatwiej rozpuszcza się w wodzie, a szkielet cząsteczki jest mniej skomplikowany i łatwiejszy do modyfikacji chemicznej, dzięki czemu prościej uzyskiwać jego pochodne.
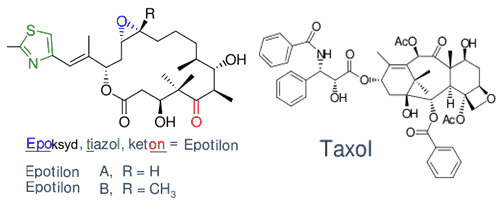
Rys. 1. Porównanie budowy cząsteczek epotilonów A i B oraz taksolu.
Podobnie jak taksany, epotilony indukują agregację tubuliny, formację multipolarnych wrzecion i zatrzymanie mitozy. Epotilony i paklitaksel współzawodniczą o tę samą kieszeń wiążącą na β-tubulinie (do której wiażą się również wewnątrzkomórkowe stabilizatory tubul, np. neuronalne białko tau). Jednakowoż sposób wiązania nie jest identyczny. Wygenerowana na podstawie badań krystalograficznych i modelowania komputerowego struktura pokazuje, że choć epotilon A i paklitaksel współzawodniczą o miejsce wiążące, każde z nich oddziałuje z nim w inny sposób. Tłumaczy to dlaczego odporne na działanie paklitakselu komórki drożdżowe okazywały się podatne na stabilizujące mikrotubule działanie epotilonów.
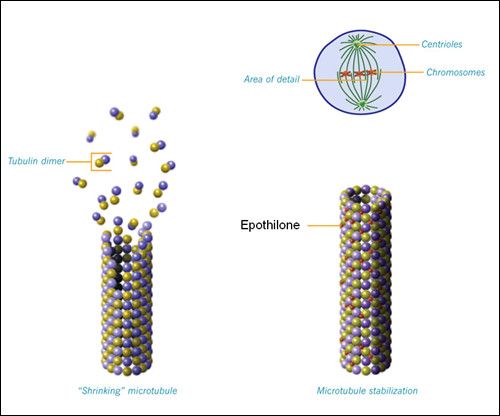
Rys. 2. Zasada działania epotilonów. [http://www.novartisoncology.com, zmienione]
Kolejne badania strukturalne ukazały, że poprzez podstawienie atomów wodoru przy C12-C13 można wpływać na zdolność wiązania do tubuliny. I tak, poprzez addycję CH3 do C12 uzyskano epotilon B, który jest dwukrotnie bardziej skuteczny w indukcji polimeryzacji tubuliny in vitro niż epotilon A czy paklitaksel. Tlen epoksydowy nie jest niezbędny w oddziaływaniu z tubuliną, czego dowodzi kolejny z otrzymanych epotilonów - epotilon D - który pozbawiony tego tlenu wykazuje jeszcze większą skuteczność indukowania polimeryzacji tubuliny.
Badania in vitro oraz in vivo ujawniły następujące fakty:
1. Epotilony wykazują aktywność względem szerokiej gamy nowotworów, w tym także nowotworów charakteryzujących się odpornością na działanie taksanów,
2. Wykazują większą toksyczność od taksanów w kulturach komórkowych - wartości IC50 (50% Inhibitory Concentration) są rzędu nanomoli,
3. Nadekspresja glikoproteiny P w niewielkim stopniu wpływa na cytotoksyczność epotilonów in vitro. Wpływ ten jest większy, lub mniejszy w zależności od typu epotilonu (epotilon – D najmniejszy; iksabepilon największy),
4. Nie wymagają leczenia wstępnego,
5. Niektóre nie stanowią substratu dla pomp odpowiedzialnych za usuwanie z komórki szkodliwych cząsteczek.
Jeżeli chodzi o raka piersi, obecnie pięć analogów epotilonów jest poddawanych próbom klinicznym. Są to:
- patupilon,
- iksabepilon,
- BMS-310705,
- epotilon D,
- ZK-EPO.
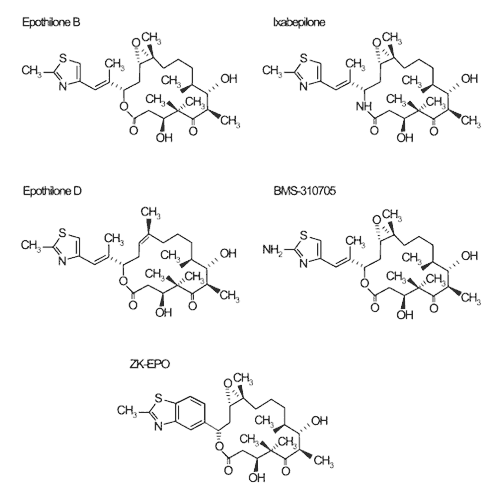
Rys. 3. Struktura cząsteczek etopilonów testowanych klinicznie m.in. w przypadku raka piersi [Cortem, Baselga, 2007].
Patupilon jest zdolny do przekroczenia bariery krew-mózg, dlatego testowany jest również w przypadkach raka mózgu. Opublikowane wyniki z fazy I/II badań patupilonu, jako terapii drugiej linii przy niedrobnokomórkowym raku płuc okazały się zachęcające. Obecnie patupilon znajduje się w fazie III badań klinicznych prowadzonych przez Novartis Oncology. Ponieważ rak piersi przerzutuje do mózgu, wykorzystanie patupilonu w jego terapii ma dodatkowe zalety.
Iksabepilon może być podawany doustnie i pomimo wysokiego poziomu ekspresji glikoproteiny P w komórkach jelita ulega dobremu wchłanianiu i zachowuje wysoki poziom aktywności w organizmie. Uzyskano odpowiedź terapeutyczną u pacjentów z czerniakiem, niedrobnokomórkowym rakiem płuc (po leczeniu docetakselem), rakiem jajnika (po leczeniu paklitakselem) oraz rakiem piersi (pacjenci nie leczeni taksanami i oporni na taksany).
BMS- 310705 jest to półsyntetyczny, rozpuszczalny w wodzie analog epotilonu B.
Analog epotilonu D, KOS-862 wykazuje aktywność równą taksanom, będąc przy tym mniej toksycznym niż one, czy epotilon B. Uzyskano odpowiedź na leczenie w stosunku do raka piersi, jak też jajników, jąder i trzustki. W fazie I/II badań znajduje się terapia kombinowana z użyciem epotilonu D, polegająca na połączeniu go z trastuzumabem w odniesieniu do pacjentów z guzami wykazującymi ekspresję receptorów HER-2. Leczeniu poddano trzynastu pacjentek z przerzutującym rakiem piersi. Nie istnieje limit jednorazowej dawki powodowany ewentualną toksycznością leku, natomiast istotny wpływ na efekt neurotoksyczny ma jego kumulacja. Zaobserwowano u jedenastu pacjentów parestezje (głównie drugiego stopnia), u połowy z nich bóle neuropatyczne, a oprócz tego zawroty głowy, zaburzenia smakowe, ataksję, bezsenność. KOS-862 testuje się także u pacjentów z rakiem jelita grubego i niedrobnokomórkowym rakiem płuc.
ZK-EPO jest całkiem syntetycznym lekiem zaprojektowanym w celu zapobieżenia tolerancji wielolekowej (MDR). Jego wysoka skuteczność wynika m.in. z faktu, iż preferencyjnie akumuluje się w jądrze i uderza głównie w komórki nowotworowe. Nie jest rozpoznawany przez pompy odpowiedzialne za zjawisko oporności (drug efflux pumps), więc pozostaje dłużej w komórce aniżeli inne epotilony. Częściowa odpowiedź (partial response - PR) została wywołana u pacjentek z rakiem piersi uprzednio leczonych taskanami. Prowadzone są próby kliniczne o różnym stopniu zaawansowania u pacjentów z rakiem prostaty i jajnika. ZK-EPO jest lepiej wodorozpuszczalny niż taksany i nie wymaga czynników formujących, jak na przykład Cremophor, co zmniejsza ryzyko efektów ubocznych.
Wykonuje się również próby kliniczne dla terapii łączącej epotilony z innymi, stosowanymi w onkologii lekami. I tak, w fazie I badań znajduje się patupilon w połączeniu z karboplatyną, kapecytabiną, gemcytabiną, a iksabepilon bada się w połączeniu z karboplatyną i kapecytabiną. Stosuje się terapię kombinowaną także w przypadku KOS-862 i ZK-EPO (karboplatyna).
Epotilony są w onkologii kolejnym krokiem naprzód. Mają zdecydowaną przewagę nad taksanami, lecz nie udało się znacząco ograniczyć toksyczności systemowej towarzyszącej z natury rzeczy toksycznym chemioterapeutykom.. Praktycznie zawsze obserwuje się biegunkę, neutropenię i bardziej lub mniej nasilone, w zależności od stosowanej pochodnej, neuropatie. Jakkolwiek, przykład epotilonów może być kolejnym dowodem na to, że leki na schorzenia nękające ludzkość natura zaprojektowała już dawno. Należy tylko je odszukać i umiejętnie zastosować. Inne związki pochodzenia naturalnego także oddziałujące z mikrotubulami to diskodermolidy (izolowane z karaibskiej gąbki Discoderma dissoluta) oraz ich bliskie analogi: diktiostatyna, indanocyna, sarkodiktyny, eleuterobiny (izolowane z miękkich korali Eleutherobia sp.), dolastatyny, kryptoficyny, halikondryna B, laulimalidy (izolowane z morskiej gąbki Cacospongia mycofijiensis) i pelurozyd A. Otwierają one nowe ścieżki badań nad lekami przeciwnowotworowymi. Być może niektóre z nich okażą się bardziej skuteczne niż epotilony, z równoczesnym ograniczeniem efektów ubocznych terapii.
Bibliografia:
1. Cortem J., Baselga J. Targeting the Microtubules in Breast Cancer Beyond Taxanes: The Epothilones. Oncologist (12): 271-280, 2007.
2. Goodin S., Kane M.P., Rubin E.H. Epothilones: Mechanism of action and biologic activity.
J. Clin. Oncol. (22): 2015–2025, 2004.
Zasoby internetowe:
1. http://www.novartisoncology.com
2. http://www.epothilones.com
---
Barbara Lachowicz jest studentką biotechnologii medycznej na Uniwersytecie Wrocławskim (2003-2008). Członkini Studenckiego Koła Biotechnologów "Przybysz", działającego w obrębie macierzystej uczelni. Naukowe zainteresowania koncentrują się wokół biologii komórki - dotyczą głównie aspektu patologii/terapii nowotworów.
