Odkrycie u roślin sposobem na raka?
Marta Pieszko | 2007-04-10
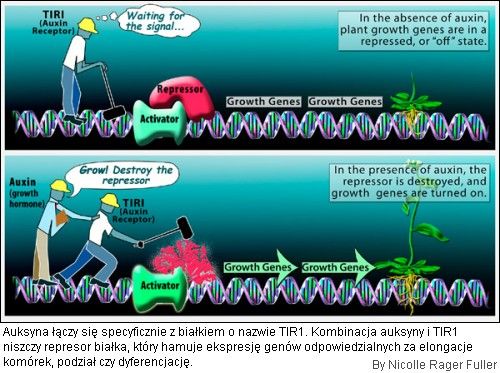
Odkryto, że roślinny hormon - auksyna wchodzi w interakcje z receptorem TIR1 (Transport Inhibitor Response 1). Może to mieć wielki wpływ na leczenie ludzkich chorób, ponieważ TIR1 jest bardzo podobny do ludzkich enzymów biorących udział w rozwoju nowotworów.
Odkrycia dokonali wspólnie naukowcy z University of Washington School of Medicine, Indiana University Bloomington oraz University of Cambridge. Wyniki badań opublikowano w Nature.
„Odkrycie tego jak auksyna (IAA) reguluje działaniem TIR1 jest wielkim postępem w biologii roślin i prawdopodobnie będzie miało duży wpływ na rozwój rolnictwa” mówi biolog Mark Estelle. "To wielki prezent na dla nas, że TIR1 ma odpowiedniki również wśród białek innych organizmów, włączając w to ludzi. Niektóre ludzkie odpowiedniki TIR1 grają znaczną w rolę w rozwoju ludzkich nowotworów, i jest prawdopodobne, że praca na roślinach pozwoli na odkrycie nowego leku."
Do tej pory enzymy takie jak TIR1, zwane ligazami ubikwityny mogły być jedynie kontrolowane przez interakcje białko-białko. Ligazy ubikwityny wpływają na wzrost roślin i ich odpowiedz na światło, łagodzenie toksyczności u drożdży oraz podział komórek nowotworowych u ludzi.
"Chociaż ligazy ubikwityny już dawno zostały rozpoznane jako potencjalny cel w leczeniu nowotworów i innych ludzkich chorób, to przed nami jeszcze daleka i wyboista droga do wytworzenia leku". mówi Ning Zheng, farmakolog z Washington School of Medicine.
Naukowcy wyizolowali i oczyścili TIR1 z często stosowanej w różnych badaniach rośliny, Arabidopsis thaliana. W wyniku naświetlania promieniami rentgena kryształów tego białka, naukowcy uzyskali jego trójwymiarową strukturę – pierwszą dla roślinnych receptorów enzymów. Następnie namoczyli kryształy w roztworze zawierającym auksynę i ponownie przeprowadzili naświetlanie promieniowanie rentgena w celu określenia gdzie auksyna została przyłączona. Na samym końcu dodano peptydu, o którym wiadomo, że TIR1 go przyłącza i modyfikuje.
Naukowcy dowiedli, że auksyna jest pewnego rodzaju "molekularnym klejem", który poprawia zdolność TIR1 do przyłączania docelowego peptydu. W przypadku nieobecności auksyny TIR1 nie przyłącza się tak mocno.
Ponieważ struktura TIR1 jest wysoce konserwatywna, włączając te z ludzkich komórek, naukowcy spodziewają się, że małe cząsteczki podobne do auksyn mogą oddziaływać również na inne ligazy ubikwityny.
Wiele ludzkich chorób, między innymi choroba Parkinsona czy nowotwór jelita grubego lub piersi jest spowodowanych upośledzonymi interakcjami między ligazami ubikwityny a ich polipeptydowymi substratami.
EurekAlert!, "Discovery in plants suggests entirely new approach to treating human cancers", 4-Apr-2007
- "Mechanism of Auxin Perception by the TIR1 Ubiquitin Ligase," Nature, Vol. 446, no. 7136